Przemiany gazowe
Stan gazu określamy za pomocą trzech podstawowych parametrów: ciśnienia \(p\), objętości \(V\) i temperatury \(T\). Parametry te mogą zmieniać się w czasie. Mówimy wówczas o przemianie stanu gazu.
W rozważaniach związanych ze zmianami stanu gazu przyjmujemy przemianę stanu gazu doskonałego, dla którego możemy zastosować równanie stanu gazu.
Jeżeli mamy do czynienia ze stałą masą gazu, to podczas przemiany zawsze zmieniają się co najmniej 2 parametry z trzech wymienionych.
Z równania Clapeyrona wynika, że:
\(pV=nRT/:T\)
\(\frac{pV}{T}=nR\)
Dla stałej masy gazu mamy więc:
Typy różnych przemian określamy dla różnych przypadków, gdy nie zmienia się jeden z powyższych parametrów lub innych parametrów stanu, wyżej nie wymienionych.
Porównanie przemian
Poniższa tablica zestawia najważniejsze cechy wybranych przemian gazowych.
| Przemiana: | izotermiczna | izobaryczna | izochoryczna | adiabatyczna |
|---|---|---|---|---|
| Nie zmienia się | temperatura (\(T=const\)) | ciśnienie (\(p=const\)) | objętość (\(V=const\)) | Nie następuje wymiana ciepła z otoczeniem (\(Q=0\)) |
| Linki | przemiana izotermiczna | przemiana izobaryczna | przemiana izochoryczna | przemiana adiabatyczna |
| Prawo | Boyle'a-Mariotte'a | Gay-Lussaca | Charles'a | Poissona |
| Wzory | \(pV=const\) | \(\frac{V}{T}=const\) | \(\frac{p}{T}=const\) | \(pV^\kappa =const\) \(TV^{\kappa -1}=const\) |
| Ciepło dostarczane do układu | \(Q=-W\) | \(Q=nC_p\Delta T\) | \(Q=nC_V\Delta T\) | \(Q=0\) |
| Praca wykonana przez gaz nad układem | \(W=-nRT\ln{\frac{V_2}{V_1}}\) | \(W=-p\Delta V\) | \(W=0\) | \(W=nC_V \Delta T\) |
| Zmiana energii wewnętrznej | \(\Delta U=0\) | \(\Delta U=nC_V\Delta T\) | \(\Delta U=Q\) | \(\Delta U=W\) |
| Przykłady układów | Gaz umieszczony w naczyniu dobrze przewodzącym ciepło, zanurzony w dużym układzie, którego temperatura nie ulega zmianie. | Gaz zamknięty w cylindrze z ruchomym tłokiem. | Gaz zamknięty w szczelnym pojemniku. | Szybko zachodzący proces lub gaz zamknięty doskonale izolowany od otoczenia. |
Wykresy przemian gazu doskonałego
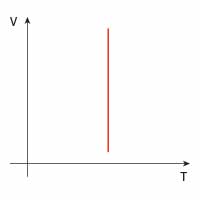
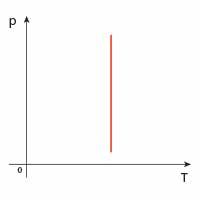
| Przemiana | \(p(V)\) | \(V(T)\) | \(p(T)\) |
|---|---|---|---|
| izotermiczna | 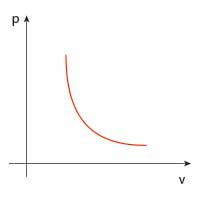 |
 |
 |
| izobaryczna | 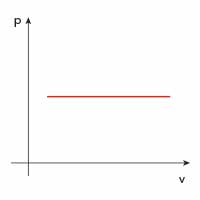 |
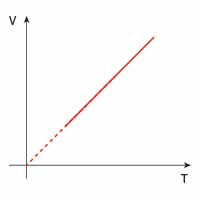 |
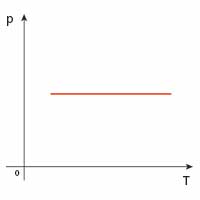 |
| izochoryczna | 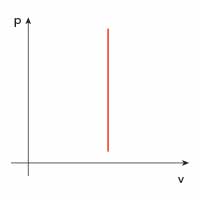 |
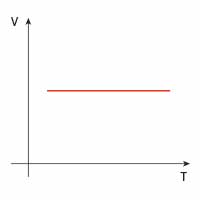 |
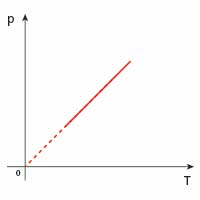 |
| adiabatyczna | 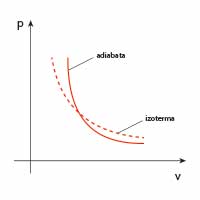 |
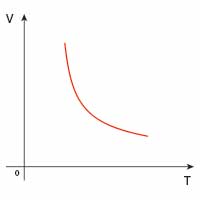 |
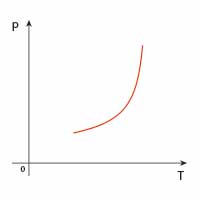 |
Inne przemiany
Czy istnieją jeszcze inne przemiany gazu doskonałego? Tak.
Proces izoentropowy - to przemiana gazu, w której nie zmienia się entropia układu. Takim procesem jest dowolny, odwracalny proces adiabatyczny.
Proces izoentalpowy - to przemiana gazu, w którym nie zmienia się entalpia układu. Przykładem są procesy dławienia.
© medianauka.pl, 2021-04-23, A-4032
Data aktualizacji artykułu: 2025-04-23





